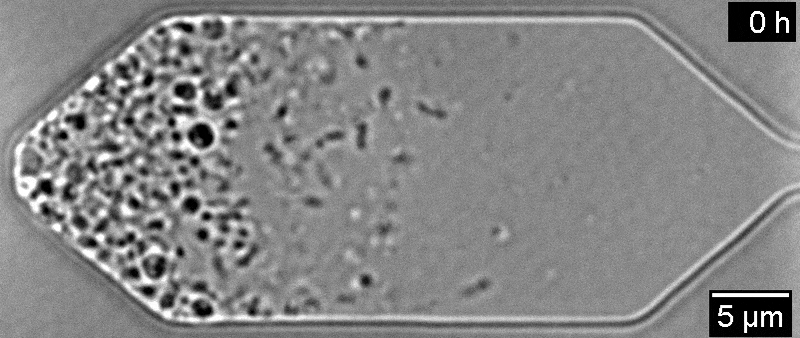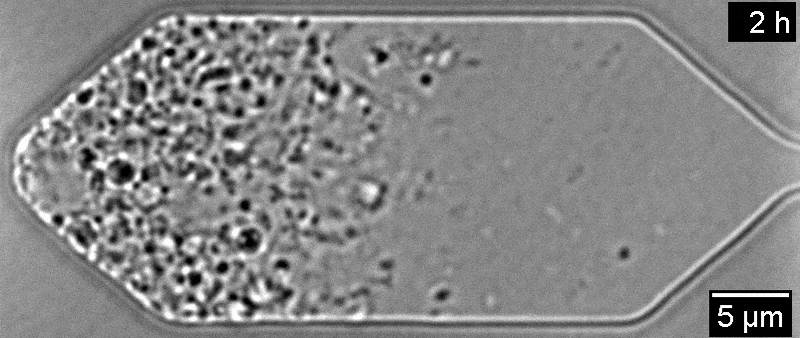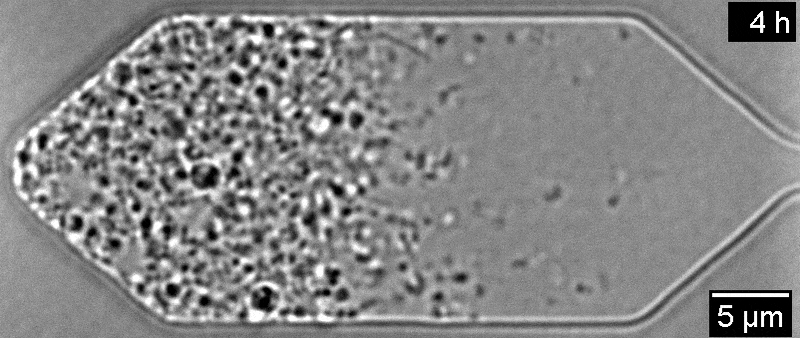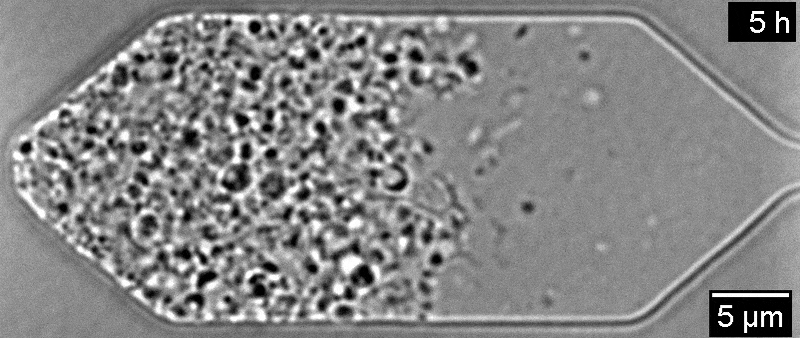
Всего одна инъекция экспериментального препарата больше чем на год восстановила зрение у пациента с амаврозом Лебера — генетической формой детской слепоты. Он участвовал в исследовании 2019 года, но не прошел полный курс лечения из-за опасений по поводу его здоровья. Об этом пишет Medical Xpress.
|
Разные: Ученые впервые проследили движение нитей ДНК внутри их белков
|

Ученые впервые детально изучили, как движутся нити ДНК внутри ядра клеток.
Ученые из МГУ им. Ломоносова выяснили сразу несколько новых механизмов, которые управляют считываемостью генов. В ходе исследования они просчитывали на атомном уровне, как меняется положение нити ДНК внутри ядра клетки.
Двойная спираль ДНК подобна винту. Предполагается, что она может одновременно скользить и прокручиваться вдоль поверхности белков ее оболочки. Нам удалось показать, что благодаря локальным деформациям ДНК и белков-гистонов этот процесс происходит поэтапно. Сначала прокручивается одна часть ДНК, а затем следующая — своего рода гусенично-винтовой механизм.
Алексей Шайтан, один из авторов работы, ведущий научный сотрудник МГУ
Общая длина всех молекул ДНК из хромосом человека составляет около 2 метров. Наши клетки сжимают нити ДНК в 10 тыс. раз, чтобы они поместились ядре. Например, клетка наматывает нить ДНК на особые молекулярные «катушки» из белков-гистонов. Благодаря этому геном можно упаковать очень компактно, но при этом значительная часть нити ДНК оказывается запрятанной внутри этих структур.
Как именно происходят движения ДНК в нуклеосоме, до последнего времени оставалось неясным. Чтобы разобраться с этим, ученые смоделировали на суперкомпьютере «Ломоносов-2» молекулярную динамику нуклеосом на атомном уровне на рекордно длинных для компьютерного моделирования временах — 15 микросекунд. То есть суперкомпьютер выступил этаким вычислительным микроскопом, что позволил рассмотреть механизмы движения ДНК в геноме.
Благодаря этому Шайтан и его коллеги проследили, как нить ДНК отсоединяется от белков, как при этом меняется ее структура и какие факторы влияют на движение цепочки нуклеотидов, а также ее повторное соединение с белковыми катушками.
Исследование вносит и важный вклад в расшифровку механизмов функционирования генома.
Первую клетку с полностью синтетическим геномом минимального размера научили корректно размножаться
Новый штамм бактерий рода Микоплазма не только обладает полностью созданной в лаборатории ДНК, но и способен правильно размножаться. Развивая свой Проект Минимального Генома, американские ученые нашли семь недостающих последовательностей нуклеотидов, необходимых для корректного деления клеток этого организма. Правда, конкретные функции пяти из них пока неизвестны, определить их — задача для дальнейшей работы.
Впервые ученые смогли создать жизнеспособную клетку с искусственным геномом в 2010 году. Этот организм назвали JCVI-syn1.0 (также известен как Mycoplasma laboratorium) и он стал отправной точкой для последующих манипуляций. Цель специалистов из Института геномики Дж. Крэйга Вентера (J. Craig Venter Institute) и их коллег из других подобных учреждений — найти минимальный размер ДНК, необходимой для поддержания жизни.
В качестве исходного материала использовалась бактерия Mycoplasma genitalium, один из основных кандидатов в возбудители воспаления мочеполовых путей у людей. Она интересна для ученых тем, что обладает самым маленьким геномом среди живых организмов, которые удалось вырастить в лаборатории (не считая вирусов, но они не реплицируются вне клетки-хозяина) — 580000 пар оснований или 482 гена.
После долгой работы и серии экспериментов по синтезу генетического материала и переносу его из реактора в заранее «очищенные» от ДНК клетки, ученые смогли найти необходимый для жизни полусинтетических микоплазм минимум — 382 гена. К моменту появления JCVI-syn3.0 удалось научить эти клетки полноценно функционировать и даже худо-бедно делиться. Но продукт такого размножения был плачевным: в результате него получались бактерии не поддерживающие шарообразную форму. Из-за этого они не могли нормально продолжать жизнедеятельность.
Новая работа, опубликованная в рецензируемом журнале Cell, показывает, что теперь ученым удалось преодолеть и эту трудность. В создании очередного штамма Mycoplasma laboratorium — JCVI-syn3A, — специалистам из Института Дж. Крэйга Вентера помогали коллеги из Массачусетского технологического института (MIT) и Национального института стандартов и технологий США (NIST). Причем именно последняя команда разработала ключевую технологию, необходимую для контроля за популяцией полусинтетических микоплазм.
Дело в том, что бактерии этого рода не имеют клеточной стенки, а также очень хрупкие и мелкие. Проводить какие-либо манипуляции с ними, не повреждая при этом нежные организмы, довольно трудно. Поэтому инженеры NIST создали специализированные миниатюрные прозрачные хемостаты — биореакторы с непрерывной циркуляцией питательной среды. Благодаря этому получилось выращивать JCVI-syn3A, проводить с ними все необходимые процедуры и легко наблюдать за делением в мощный оптический микроскоп (микоплазмы еще и очень мелкие — в сотни раз меньше кишечной палочки).
Чтобы JCVI-syn3A делился корректно и в результате получались правильные шарообразные бактерии, этому штамму вернули 19 генов, которые ранее отсекли от ДНК JCVI-syn3.0. Семь из них в ходе экспериментов определили, как необходимые для размножения. Что интересно, функции только двух этих критически важных комбинаций нуклеотидов до конца ясны ученым. Что конкретно делают еще пять — предстоит установить позднее, в текущей научной работе цель стояла иная.
Создание полноценного микроорганизма с искусственным геномом минимально возможного размера позволит выполнить заветную мечту многих биологов: конструировать живые инструменты. Добавляя или удаляя фрагменты ДНК с известными функциями ученые смогут буквально программировать бактерии на любые цели. Перспективы огромны: производство медикаментов и конкретных химических веществ, в том числе переработка отходов, адресная доставка лекарств в организм человека, биосенсоры и биокомпьютеры — иными словами, на что только хватит воображения.

Несмотря на впечатляющий прогресс, впереди у специалистов по геномике работы еще невпроворот. Как хорошо видно, если оценивать эффективность экспериментов по длине ДНК, то в своих изысканиях они только подобрались к достижениям эволюции. Судите сами: Mycoplasma genitalium — 482 гена, JCVI-syn1.0 — 901 ген (около миллиона пар оснований), JCVI-syn3.0 — 473 гена, а JCVI-syn3A — 480. Правда, не стоит забывать, что в синтетической ДНК специально были добавлены фрагменты, позволяющие однозначно отличить искусственный штамм от «дикого» и делающие его не заразным. Прогресс есть и он впечатляет, особенно учитывая огромный багаж полученных знаний о генетике микроорганизмов.
Покрытая сахаром полимерная гранула в 500 раз эффективнее доставила ДНК в клетку
Российские и американские ученые разработали инновационную невирусную систему доставки ДНК в клеточные культуры иммунных клеток. Ранее уже были попытки использовать гранулы ДНК с положительно заряженным полимером, однако у такого метода была низкая эффективность. В своей работе ученые дополнительно покрыли гранулы сахаром маннозой и увеличили эффективность доставки в 500 раз. Разработка поможет лечить раковые опухоли.
Результаты исследования, поддержанного грантом Российского научного фонда (РНФ), опубликованы в журнале Macromolecular Bioscience. Генная инженерия все больше входит в повседневную жизнь каждого человека: модификации генов используют для повышения урожайности и устойчивости растений к патогенам, а также для получения новых штаммов бактерий и грибов, которые могут синтезировать практически любые вещества, начиная от топлива и заканчивая антибиотиками. Кроме того, такой подход может помочь лечить болезни человека и животных, например, возвращать способность видеть при потере зрения.
Для медицинских целей необходимо сделать доставку ДНК в целевую клетку как можно более безопасной. Существует множество методов, однако наиболее оптимальным считается использование вирусных частиц: они прилипают только к белкам на поверхности определенных клеток и, кроме того, не вызывают их гибель. Хотя вирусные доставщики не содержат собственного генетического материала и не могут размножаться в клетках, процесс их синтеза и сборки сложен и требует контроля на всех этапах производства, чтобы не допустить появления настоящих вирусов.
Невирусные доставщики ДНК тоже можно улучшить таким образом, чтобы генетический материал поступал только в конкретные клетки организма, например в макрофаги. Макрофаги одни из иммунных клеток в норме должны защищать организм от инфекций и рака. Однако если уже есть опухоль, она может «завербовать» часть макрофагов для своей защиты от остального иммунитета.
Методы генной инженерии могут помочь уничтожить таких клеточных «предателей» или рекрутировать их назад, тем самым ослабив опухоль. В своей работе исследователи из Московского государственного университета имени М. В. Ломоносова, Небрасского университета (Омаха) и Университета Северной Каролины (Чапел-Хилл) эффективно доставили ДНК в клетки с помощью положительно заряженных полимеров.
Положительный заряд в этом случае нужен для связывания отрицательно заряженной ДНК. Из таких полимеров самопроизвольно собираются частицы, которые дальше можно модифицировать: добавить дополнительные связи внутри клубка и тем самым сделать его более прочным или покрыть частицу оболочкой. Ученые определили способность доставлять генетический материал у частиц из двух разных полимеров, содержащих в составе аминокислотные мономеры из лизина или аспарагиновой кислоты. Они оценивали, как дополнительные сшивки и оболочка из сахара маннозы влияют на выживаемость макрофагов и способность частиц помещать генетический материал в эти клетки.
В клетку доставляли ДНК флуоресцентных белков, которая способна заставить клетку светиться. Это помогло определить, удалось ли перенести в клетку нуклеиновые кислоты с помощью полимерных частиц: чем сильнее свечение культуры клеток, тем успешнее доставка. Оказалось, что среди всех исследуемых вариантов наиболее эффективны полимерные частицы с аспарагиновой кислотой, покрытые маннозой и без внутренних сшивок. В этом случае выживает 80 процентов клеток, что выше, чем у некоторых популярных методов. Например, при бомбардировке клеток золотыми частицами с ДНК выживает лишь половина. Более того, эффективность переноса нуклеиновых кислот у таких частиц в 500 раз больше показателя для клубков полимера без маннозной оболочки.
«Несмотря на успех наших опытов, эффективность доставки была немного меньше, чем для некоторых известных аналогов, предложенных для доставки ранее. Однако они не направлены специфически в иммунные клетки и не могут быть применены на людях из-за своей высокой токсичности. В отличие от таких подходов, наш метод подходит для человека», комментирует руководитель проекта по гранту РНФ Александр Кабанов, член-корреспондент РАН, доктор химических наук, руководитель лаборатории химического дизайна бионаноматериалов химического факультета Московского государственного университета имени М. В. Ломоносова.
В Сколтехе найден новых механизм регуляции экспрессии генов
Группа ученых из России изучила роль двухцепочечных фрагментов РНК в процессе ее созревания. Было показано, что взаимодействие между удаленными участками РНК может регулировать процессы созревания информационных молекул РНК.
Результаты исследования опубликованы в журнале Nature communications. В школьной программе обычно рассказывают, что ДНК имеет двухцепочечную структуру, а РНК одноцепочечную, однако это не совсем так. Ученым известно множество примеров, где РНК образует двуцепочечную вторичную структуру, играющую важную роль в функционировании этих молекул. Вторичные структуры РНК принимают участие в регуляции работы генов.
Двухцепочечные участки в РНК адаптируют молекулы под конкретные функции, и утрата таких структур приводит к тяжелым заболеваниям. Двойная цепочка может образовываться между комплементарными участками, напротив А должна оказаться буква У, а напротив Ц буква Г, иначе цепи не «прилипнут» друг к другу.
Большинство таких прилипающих участков расположены недалеко друг от друга, а вот роль взаимно комплементарных участков, разнесенных на большие расстояния, до настоящего момента была плохо изучена.
Группа ученых из Центра наук о жизни Сколтеха под руководством профессора Сколтеха Дмитрия Первушина в сотрудничестве с отечественными и зарубежными лабораториями с помощью молекулярно-биологических и биоинформатических методов проанализировали строение и роль удаленных друг от друга комплементарных участков РНК, способных образовывать вторичные структуры. Оказалось, что такие вторичные структуры играют важную роль в процессе сплайсинга.
Сплайсинг – это процесс созревания информационных молекул РНК, когда в процессе транскрипции (считывания информации с ДНК) из образующейся РНК вырезаются некодирующие участки, а кодирующие сшиваются между собой. Учеными была показана возможность регуляции сплайсинга вторичными структурами РНК, что вносит существенный вклад в регуляцию работы генов.
«Эта публикация — результат многолетней работы нашей научной группы в направлении изучения вторичной структуры РНК и ее роли в регуляции экспрессии генов. Мы опубликовали большой каталог потенциально важных РНК-структур, полученный вычислительным путем, однако экспериментальная работа в этом направлении только начинается», – комментирует исследование профессор Дмитрий Первушин.
Новый метод покажет, как РНК влияет на активность генома
Международная группа ученых, в которую входит представитель ФИЦ биотехнологии РАН, ИОГЕН и МФТИ, разработала новый, более надежный метод для изучения контактов РНК с ДНК в ядре клеток. Метод поможет определить роль РНК в регуляции работы генов.
РНК и активность генов
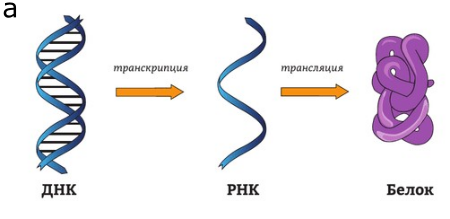
Статья об исследовании опубликована в Nature Communication. Работа была поддержана Российским научным фондом (РНФ). Ранее считалось, что РНК — это лишь промежуточная стадия между ДНК и белком (рисунок 1а). Но когда научный мир начал описывать работу генома, оказалось, что далеко не все участки ДНК кодируют РНК. Более того, даже те, с которых считывается РНК, не обязательно кодируют белки.
Функция большинства некодирующих РНК до сих пор неочевидна. В разных типах клеток должны работать разные гены и синтезироваться разные белки: в клетке мозга — одни, в клетке крови — другие. Это значит, что существуют факторы, которые влияют на активность генов. Теперь ученые начали понимать, что некодирующие РНК также являются одним из этих факторов.
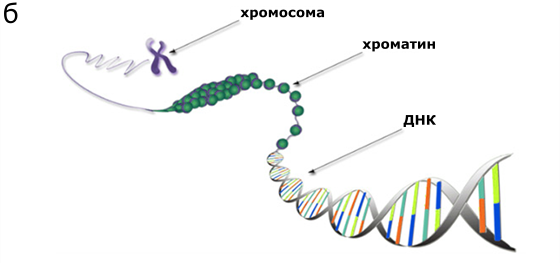
Известно, что длинные некодирующие РНК взаимодействуют с хроматином — веществом, которое представляет собой молекулу ДНК, плотно упакованную с помощью белков (рисунок 1б). Хроматин может менять свою структуру: разворачиваться и сворачиваться, открывая гены для считывания или, наоборот, закрывая их.
Если некодирующие РНК связываются с определенными участками хроматина, они могут влиять на его структуру и таким образом регулировать активность этих участков. Чтобы понимать, как регулируется активность генов и как это влияет на специализацию клетки, необходимо знать, какие некодирующие РНК с какими участками связываются.
Как это работает
Есть несколько методов, которые позволяют определять места, где взаимодействуют РНК и хроматин. Однако из-за ряда ограничений они пропускают много взаимодействий, к тому же некоторые из них требуют для анализа большого количества материала или разрушения клетки. Авторы работы разработали новый метод, который не разрушает клетку до закрепления контактов РНК и хроматина и показывает более высокую точность, — они назвали его RADICL-seq.
 Рисунок 2. а) Реакции, производимые в ядре клетки. Красным показана РНК, черным – ДНК, голубым — белки, синим — связующая молекула. Черная точка — молекула, позволяющая «выцепить» комплекс из раствора. Пояснения даны в тексте. b) Реакции, производимые в растворе: 1) удаляются белки, 2) достраивается вторая цепь, 3) обрезается до определяемого размера, 4) присоединяются последовательности для распознавания и 5) производится секвенирование / ©Nature Communication
Рисунок 2. а) Реакции, производимые в ядре клетки. Красным показана РНК, черным – ДНК, голубым — белки, синим — связующая молекула. Черная точка — молекула, позволяющая «выцепить» комплекс из раствора. Пояснения даны в тексте. b) Реакции, производимые в растворе: 1) удаляются белки, 2) достраивается вторая цепь, 3) обрезается до определяемого размера, 4) присоединяются последовательности для распознавания и 5) производится секвенирование / ©Nature Communication
В ядре клетки большинство РНК связаны с хроматином: РНК закрепляется в белках, которые связывают ДНК. Метод RADICL-seq заключается в следующем. В ядро добавляется фермент, который делает разрывы на ДНК и оставляет свободные концы, пригодные к сшивке. Также добавляется фермент, который разрушает свободные РНК и тем самым повышает точность определения контактов. Потом добавляют молекулу, у которой один конец — одноцепочечный и связывается с РНК, а второй — двухцепочечный и связывается с расположенной рядом ДНК (рисунок 2а).
Таким образом, эта молекула служит мостиком, скрепляющим РНК и ДНК. Дальше удаляют белки, достраивают вторую цепочку и получившийся ДНК-комплекс готовят к секвенированию (рисунок 2b), где определяют последовательности связанных РНК и ДНК.
Раскодировать некодирующее
Ученые проверили метод RADICL-seq в действии. По сравнению с другими методами, он показал более высокую точность определения хроматин-РНК-взаимодействий. Благодаря высокому разрешению метода авторам удалось найти новые контакты не только некодирующих, но и кодирующих РНК с хроматином, включая те, которые расположены вдали от мест, где данная РНК считывается.
Также они показали на клетках мыши, что метод подходит для изучения специфики взаимодействий в разных типах клеток. Они взяли две некодирующие РНК (одна из них, возможно, связана с шизофренией) и построили карту их взаимодействий с геномом в двух типах клеток: эмбриональных стволовых и предшественников олигодендроцитов (нейроглиальных клеток). Карты получились характерными для данных типов клеток и РНК (рисунок 3).
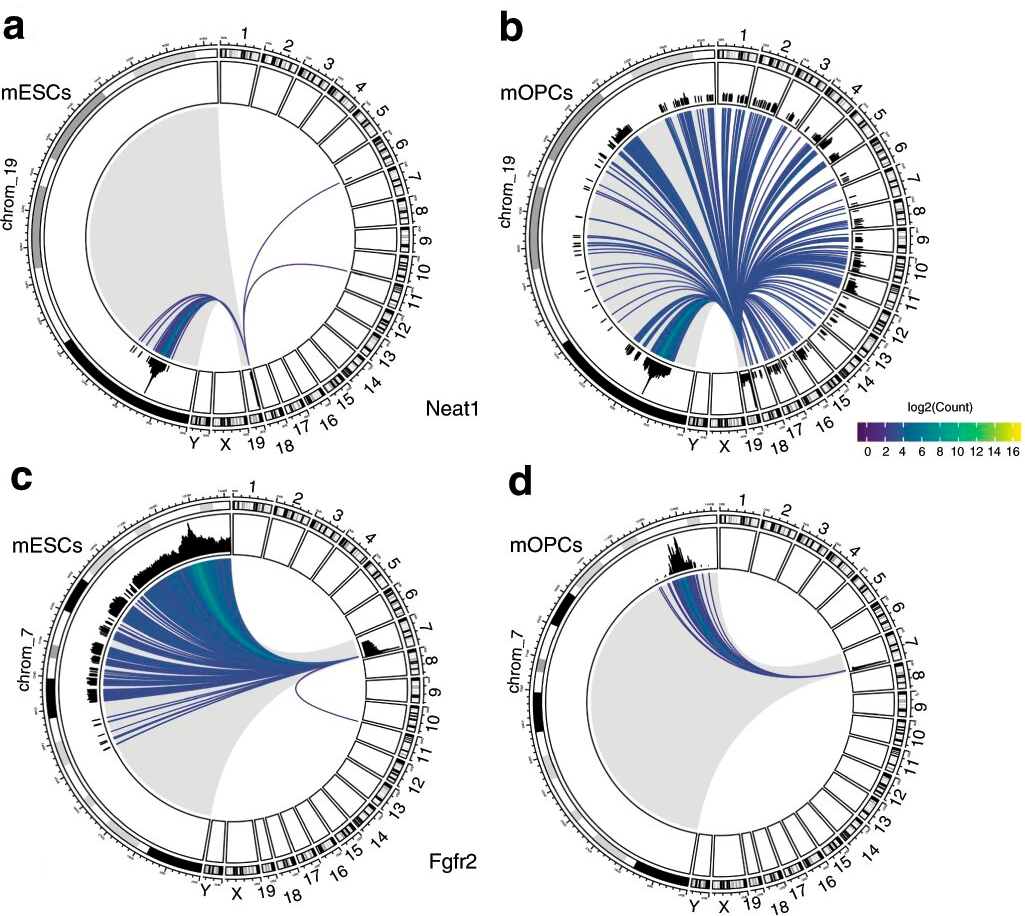
Исследование подтвердило важную роль длинных некодирующих РНК в регуляции участков генома, удаленных от мест считывания этих РНК. Гибкость метода RADICL-seq позволяет получить дополнительную биологическую информацию при внесении изменений в эксперимент. В частности, дает возможность обнаружить взаимодействия РНК-ДНК, не опосредованные белками хроматина.
Наличие таких контактов указывает на роль в регуляции экспрессии генов не только канонических взаимодействий (таких как РНК-ДНК двойные спирали), но и неканонических (триплексов РНК-ДНК-), а также на значение некодирующих РНК в нацеливании белковых комплексов в конкретные места генома.
«Мы планируем дальше исследовать, как РНК участвует в регуляции экспрессии генов, архитектуры хроматина и, в конечном счете, на идентичность клеток. Вполне возможно, что в будущем с помощью этих некодирующих РНК можно будет контролировать активность конкретных генов, что важно, например, для лечения различных заболеваний», — прокомментировала Юлия Медведева, заведующая группой регуляторной транскриптомики и эпигеномики ФИЦ биотехнологии РАН и заведующая лабораторией биоинформатики клеточных технологий МФТИ, руководитель проекта по гранту РНФ.
Ученые впервые внесли целевые изменения в митохондриальную ДНК
Большинство клеток нашего организма имеют сразу две «генетические библиотеки». Одна из них находится в ядре, вторая — в митохондриях, «энергетических станциях» клетки. До сих пор ученые знали, как внести направленные изменения только в ядерную ДНК. Статья, опубликованная американскими исследователями в Nature, описывает способ целевого редактирования митохондриальных нуклеиновых кислот.
Основой для технологии, позволяющей вносить изменения в геном митохондрий, стал токсин Ddda. Он синтезируется грамотрицательными бактериями Burkholderia cenocepacia, помогая им конкурировать за питательные ресурсы с другими микроорганизмами. Этот токсин катализирует изменения в ДНК, превращая один из ее нуклеозидов, цитозин, в урацил — азотистое основание, характерное для РНК.
Это далеко не первый случай, когда у микроорганизмов обнаруживаются «инструменты», помогающие вносить изменения в гены. В генной инженерии активно используются деаминазы — ферменты, которые также превращают цитозин в урацил, заменяя аминогруппу NH2 на атом кислорода. Однако этот фермент работает лишь на однонитевой ДНК, в то время как в наших митохондриях она двухнитевая.
Теоретически эту проблему можно было решить при помощи системы редактирования генов CRISPR-Cas9 в комплексе с деаминазами и дополнительными ферментами для расплетания двухнитевой ДНК. Однако использование такого подхода затрудняет селективная мембрана митохондрий: в частности, она не пропускает относительно громоздкие РНК-матрицы, необходимые в такой методике для идентификации определенных последовательностей ДНК.
Использование Ddda, который способен работать с двухцепочечной ДНК, позволило обойти эти препятствия. Исследователи соединили токсин с так называемым TALE-белком, который способен распознавать определенные домены в ДНК и связываться с ними. Комплекс Ddda-TALE находит в митохондриальных генах нужную последовательность и меняет в ней цитозин на урацил; последний позже превращается в тимин — другое азотистое основание, характерное для ДНК.
Лабораторные тесты показали, что Ddda-TALE дает нужные ученым изменения в генетическом коде примерно в 50% случаев. На первый взгляд это не кажется таким уж хорошим результатом. Однако при отсутствии других подходящих кандидатов на роль инструмента для редактирования митохондриальных генов, а также учитывая отсутствие каких-либо признаков потенциально катастрофических изменений за пределами целевых последовательностей, это достижение — серьезный научный успех.
Как и мутации в ядерной ДНК, генетические изменения в митохондриальных генах могут влиять на состояние организма, вызывая различные патологии, которые передаются потомству. Дальнейшее развитие технологии Ddda-TALE должно помочь в разработке и внедрении надежного инструмента, который позволит устранять такие мутации.