|
Университет Кэйо одобрил план пересадки сердечных клеток, созданных на основе iPS
|

Группа экспертов Университета Кэйо утвердила план клинических исследований по пересадке сердечных клеток, созданных из индуцированных плюрипотентных стволовых клеток (iPS) пациентам с сердечными заболеваниями, как сообщают информированные источники.
Источники сообщили, что группа, в которую входит профессор сердечно-сосудистой медицины Фукуда Кэйити, намерена реализовать этот план уже этим летом после одобрения в министерстве здравоохранения.
Трансплантация будет проводиться троим людям в возрасте от 20 до 75 лет, страдающим дилатационной кардиомиопатией – состоянием, при котором снижается способность сердца перекачивать кровь.
План исследований включает введение около 50 миллионов скоплений клеток сердечной мышцы, трансформированных из клеток iPS, предоставленных Университетом Киото, в сердце каждого пациента. Затем исследователи будут наблюдать пациентов и выяснят, не становится ли сердцебиение нерегулярным, не превращаются ли трансплантированные клетки в злокачественные и восстанавливаются ли сердечные функции пациентов.
В Японии провели первую в мире трансплантацию сердечных клеток, созданных из индуцированных плюрипотентных стволовых клеток (iPS)
27 января команда Университета Осаки сообщила, что при клиническом исследовании была проведена первая в мире трансплантация клеток сердечной мышцы, созданных из индуцированных плюрипотентных стволовых клеток, или клеток iPS.
В клиническом проекте по проверке безопасности и эффективности терапии с использованием индуцированных плюрипотентных стволовых клеток Сава Ёсики, профессор отделения сердечно-сосудистой хирургии университета, и его коллеги ставят целью трансплантировать листы клеток сердечной мышцы в общей сложности 10 пациентам, страдающим от серьезной сердечной недостаточности, вызванной ишемической кардиомиопатией, в течение трёх лет.
В этом месяце команда провела успешную операцию, пациент переехал в общее отделение больницы.
Ожидается, что клетки на разлагающихся листах, прикрепленных к поверхности сердца пациентов, будут расти, чтобы секретировать белок, который может регенерировать кровеносные сосуды и улучшать функцию сердца. Каждый лист имеет ширину около 4-5 сантиметров и толщину 0,1 миллиметра. Полученные из клеток крови здоровых доноров клетки iPS уже поступили на хранение.

[Авторское право The Jiji Press, Ltd.]

Японские исследования iPS-клеток на пути к практическому применению: новые успехи
Использование существующих препаратов контроля иммунитета в борьбе с трудноизлечимыми недугами
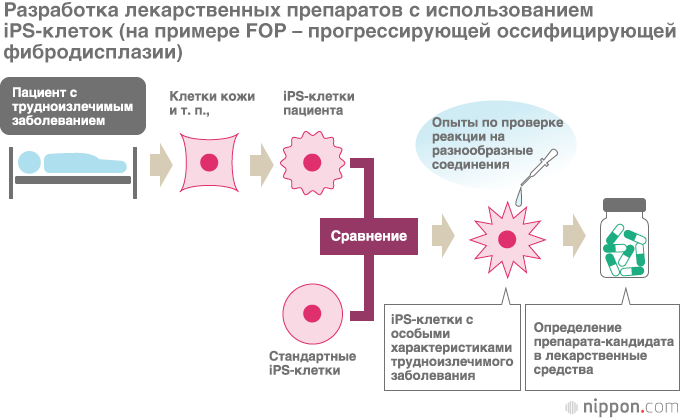
iPS-клетки – это клетки, способные преобразовываться в различные виды клеток организма (клетки мышц, костей, сердца, печени, кровеносных сосудов, нервной системы и т. д.), для получения которых достаточно воспользоваться клетками кожи, кровяными и некоторыми другими клетками. Со времени открытия iPS-клеток профессор Яманака наряду с регенеративной медициной отмечал в качестве одного из важнейших направлений клинического применения этих клеток создание лекарственных препаратов, и с сентября 2017 года начались клинические испытания медицинского препарата, предлагаемого в качестве лекарства от трудноизлечимого заболевания – прогрессирующей оссифицирующей фибродисплазии (FOP). Клинические испытания лекарства, открытого с использованием iPS-клеток, проводятся впервые в мире. Этим исследованием занимается заместитель руководителя Центра исследований iPS-клеток Киотского университета Тогутида Дзюнъя.
Прогрессирующая оссифицирующая фибродисплазия – трудноизлечимое генетическое заболевание, которое развивается с детского возраста. У больного по всему телу происходит преобразование в костные ткани грубоволокнистых соединительных тканей – мышц, сухожилий и связок, ограничивая подвижность суставов и деформируя кости. Человек лишается способности нормально питаться, затем затрудняется дыхание, и в конце концов больной умирает. Заболевание редкое – один случай на два миллиона человек, и в стране насчитывается порядка 80 человек с данным диагнозом. Учёные определили гены, вызывающие заболевание, однако эффективного метода его лечения не существует. Заболевание отнесено к числу недугов, лечение которых субсидируется государством.
Тогутида Дзюнъя использовал iPS-клетки, полученные из клеток пациентов с данным заболеванием, чтобы выявить вещества, подходящие в качестве лекарства, замедляющего развитие FOP. Сначала удалось добиться успеха в преобразовании взятых у пациента клеток в iPS-клетки. Путем сопоставления этих клеток со стандартными iPS-клетками удалось подтвердить воспроизводство заболевания FOP – заметно более высокую способность к преобразованию в костные и хрящевые клетки, и таким образом прояснить механизм аномального образования костных тканей у больного FOP. Затем, раз за разом наблюдая за реакцией этих iPS-клеток на воздействие различными соединениями, исследовав более 6 800 веществ, удалось обнаружить, что иммуносуппрессант рапамицин обладает нужным эффектом, подавляя преобразование в костные ткани.
Этот препарат используется в Европе для подавления реакции отторжения при проведении операций по пересадке органов (в Японии не одобрен), а в 2014 году препарат был одобрен в Японии в качестве средства для лечения редкого и трудноизлечимого заболевания – лимфангиолейомиоматоза. Такой метод использования уже существующего лекарственного средства в лечении совершенно иного заболевания, называемый переориентацией лекарства (DR), считается весьма безопасным ввиду отсутствия неизвестных побочных эффектов и т. п.
Нынешние клинические испытания, помимо Киотского университета, ведутся в больницах при Токийском университете, а также при университетах Нагои и Кюсю. Двадцать пациентов в возрасте от шести лет и старше разделили на две группы, в одной из которых на протяжении полугода пациенты получают рапамицин. Проверив таким образом его эффективность, исследователи ставят целью добиться одобрения этого препарата в качестве средства для лечения FOP.
Поскольку в случае переориентации уже существующего лекарственного средства проверки на безопасность для человеческого организма уже были проведены, а показатели фармакокинетики проверены на практике, это позволяет радикально снизить сумму издержек по сравнению с разработкой нового лекарства. Но ввиду того, что в случае трудноизлечимых заболеваний, которым подвержено небольшое число людей, фармацевтические компании не могут рассчитывать на получение прибыли, дело сложно довести и до проведения клинических испытаний – процесса, который обходится в сотни миллионов йен. Поэтому в таких случаях с целью расширить сферу применения существующих лекарств клинические испытания под руководством врачей финансируются из государственного бюджета.
Упрощение клинических испытаний безопасности и эффективности
С помощью iPS-клеток, полученных от пациентов с определённым заболеванием (iPS-клеток с присущими заболеванию отличиями) становится возможным воспроизвести особое состояние клеток, характерное именно для данного недуга. Кроме того, это позволяет при проведении проверки лекарственного препарата на безопасность и эффективность не полагаться на опыты на животных, а проделывать необходимую работу, используя такие iPS-клетки.
Появляются надежды на создание лекарств не только для лечения FOP. В Университете Кэйо исследователи под руководством профессора Окано Хидэюки обнаружили препарат, который может послужить лекарством от бокового амиотрофического склероза (болезни Шарко), поражающего двигательные нейроны, и уже в 2018 году планируют приступить к клиническим испытаниям.
Кроме того, профессор Окано и его коллеги обнаружили, что рапамицин способен препятствовать отмиранию клеток внутреннего уха при наследственной глухоте (синдроме Пендреда). К тому же, группа под руководством профессора Фукуды Кэйити в Университете Кэйо обнаружила, что уже существующее лекарство, используемое для лечения лёгочной гипертензии, демонстрирует эффект при гипертрофической кардиомиопатии – наследственном заболевании, при котором происходит утолщение мышечных волокон сердца.
В Центре исследований iPS-клеток Киотского университета группа профессора Цумаки Нориюки обнаружила препарат, который, возможно, можно применять для трудноизлечимых костных заболеваний – хондродистрофии, при которой аномальное формирование клеток хрящевых тканей приводит к малорослости, а также танатофорной дисплазии. Это широко используемое по всему миру средство для понижения уровня холестерина – статин. Исследователи занимаются подтверждением его свойства восстанавливать рост костей.
Выход на этап клинических исследований в регенеративной медицине: глазная сетчатка, сердечная мышечная ткань и др.
В регенеративной медицине, которая является ещё одним важным направлением клинического использования iPS-клеток, в 2013 году Институт физико-химических исследований RIKEN в рамках проекта под руководством Такахаси Масаё приступил к клиническим исследованиям метода лечения трудноизлечимой возрастной макулодистрофии, использующего клетки, полученные из iPS-клеток. Вслед за этим в Осакском университете профессор Сава Ёсики (генеральный директор Японского научного общества регенеративной медицины) в ближайшем будущем намеревается приступить к клиническим опытам по пересадке пациентам с тяжёлыми заболеваниями сердца сердечных мышечных тканей, изготовленных из iPS-клеток. Эта разработка была проведена совместно с корпорацией Terumo.
Уже упомянутый профессор Окано Хидэюки из Университета Кэйо также ведёт подготовку к пересадке пациентам с повреждениями спинного мозга нейрональных стволовых клеток, полученных путём преобразования iPS-клеток. Кроме того, профессор Такахаси Дзюн из центра исследований iPS-клеток Киотского университета в августе 2017 года объявил о том, что в результате пересадки обезьяне с симптомами болезни Паркинсона нервных клеток, полученных из iPS-клеток, произошло ослабление дрожания верхних и нижних конечностей, а также других симптомов. Впервые подтвердив эффект на близких к человеку приматах, исследователи ставят целью приступить к клиническим опытам уже в 2018 финансовом году.
В более отдалённой перспективе исследователи мечтают создавать целиком отдельные жизненно важные органы. Профессор Сава Ёсики, говоря о регенеративной медицине через 30 лет, отметил: «Если речь идёт о таких органах с простыми функциями, как, к примеру, сердце, чья работа состоит в сжатии – возможно, мы сможем создавать такие органы целиком».
В Центре исследований iPS-клеток, который возглавляет профессор Яманака Синъя, в 2013 году начали работу по созданию банка iPS-клеток из материала людей, чей тип иммунитета отличает слабость реакции отторжения, и уже в 2017 году этот банк будет состоять из iPS-клеток типов, подходящих для 30 процентов японцев. Банк будет поставлять эти iPS-клетки и для клинических опытов по лечению возрастной макулодистрофии, а также по пересадке сердечных мышечных тканей. Вместе с тем на пути к клиническому использованию, опираясь на фундаментальные исследования iPS-клеток, предстоит решить целый ряд задач, главные из которых – предотвращение преобразования в раковые клетки, повышение качества клеточного материала и преобразование в клетки различных органов.
Фотография к заголовку: профессор Осакского университета Сава Ёсики на пресс-конференции после подачи заявки на проведение клинических исследований лечения сердечной недостаточности с использованием iPS-клеток, 21 июля 2017 г., преф. Осака, город Суйта (фотография предоставлена Jiji Press)
C мечтой о регенеративной медицине: прогресс исследований iPS-клеток
Идея регенеративной медицины одновременно стара и нова. Человек издавна мечтал о возможности вернуть утраченное зрение, силу обездвиженным конечностям, заставить биться с новой силой изношенное сердце... В широком смысле к регенеративной медицине можно отнести очки и протезы, искусственные органы и другие заменяющие средства. Метод клеточной терапии, преследовавший цель решить все эти задачи путём пересадки клеток, привлёк к себе живое внимание 35 лет назад. В 1981 году были получены эмбриональные стволовые клетки (ES-клетки) из эмбриона мышей, а в 1998 году – ES-клетки человека.
Около 60 триллионов клеток взрослого организма человека образуются благодаря многократному делению, началом которого служит одна-единственная оплодотворённая яйцеклетка. Стволовые клетки при делении способны не только воспроизводить сами себя, но и преобразовываться в различные другие типы клеток (то есть обладают плюрипотентностью). Таким образом из оплодотворённой яйцеклетки производятся самые различные клетки, составляющие живой организм.
Эмбриональные стволовые клетки получают из эмбриона ранней стадии – всего после 6-7-кратного деления оплодотворённой яйцеклетки. Эти обладающие свойством плюрипотентности (способностью преобразовываться в разнообразные клетки, формирующие живой организм) клетки можно размножать практически без ограничений. С одной стороны, на ES-клетки возлагают большие надежды как на исходный клеточный материал для регенеративной медицины. В то же время на этом пути остаётся ряд нерешённых задач. Это и технология безопасного стимулирования преобразования в необходимый вид клеток, и технология подавления реакции отторжения, и, наконец, самое серьёзное препятствие: морально-этическая проблема, связанная с тем, что материал производится из оплодотворённых человеческих яйцеклеток.
В обстановке, когда весь мир занимался исследованиями, стремясь заставить эмбриональные стволовые клетки преобразовываться нужным образом в ткани организма, профессор Яманака пошёл совершенно иным путём, который и привёл его к успеху в получении плюрипотентных стволовых клеток, не уступающих эмбриональным стволовым.
Стволовые клетки, не вызывающие сомнений в этичности: Нобелевская премия 2012 года
Из 24-х генов, часто выявляемых в эмбриональных стволовых клетках, были определены четыре, которые впоследствии стали называть «генами Яманаки» (Oct3/4、Sox2、Klf4、c-Myc). При внедрении этих генов в кожные клетки мышей с использованием ретровируса в качестве доставщика генетического кода (вектора) были получены плюрипотентные стволовые клетки, подобные эмбриональным стволовым. В названии клеток – iPS-клетки (induced pluripotent stem cell, «индуцированная плюрипотентная стволовая клетка») – была намеренно использована маленькая буква i по аналогии с получившим тогда распространение по всему миру продуктом фирмы Apple – компактным аудиоплеером iPod.
Детальная техника получения, а также состав четырёх генов были опубликованы в британском научном журнале Cell от 25 августа. Но для того, чтобы использовать iPS-клетки при лечении человека, требовалось получить их из человеческого материала. В случае эмбриональных стволовых клеток для перехода от мышиного материала к человеческому потребовалось 17 лет. В создании iPS-клеток человека профессор Яманака добился успеха уже в 2007 году.
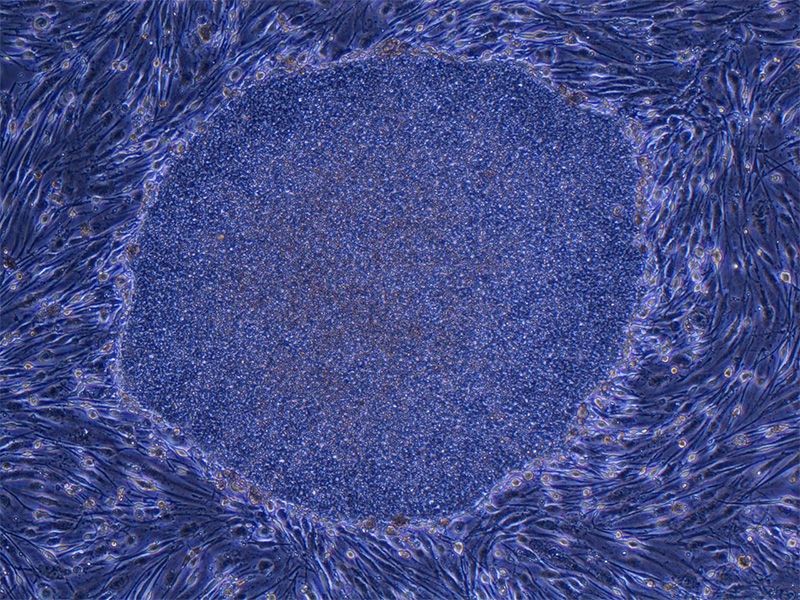
Колония (группа) iPS-клеток человека, выращенных из клеток фибробласта (соединительной ткани). Размер колонии – приблизительно 0,5 мм в поперечнике (фотография предоставлена профессором Яманака Синъя)
Профессор Яманака Синъя отвечает на вопросы на форуме для учащихся полных средних школ, который состоялся 4 ноября 2011 года в Токио (фотография предоставлена Центром исследований iPS-клеток Киотского университета)
В iPS-клетках скрыт потенциал, который способен изменить всю клиническую медицину в целом, не ограничиваясь регенеративной медициной. К примеру, они породили надежду на то, что сопоставление инициализированных iPS-клеток человека с клетками его поражённых заболеванием органов позволит понять механизм развития заболевания и приведёт к созданию лекарства от болезни. Новость об iPS-клетках приветствовали даже такие противники использования эмбриональных стволовых клеток из этических соображений, как президент США Джордж Буш и Папа Римский. Несмотря на то, что на тот момент эти клетки не спасли ни одного больного, в 2012 году профессор Яманака Синъя был удостоен Нобелевской премии по физиологии и медицине.
Открытие iPS-клеток человека дало старт конкуренции на пути к реализации мечты о регенеративной медицине.
Первоначальный метод получения вызывал опасения в связи с превращением клеток в раковые, к тому же эффективность производства была крайне низкой, но благодаря пересмотру техники получения, а также используемых генов, безопасность удалось повысить, и в результате в 2014 году приступили к клиническому испытанию. Двенадцатого сентября в больнице Центра передовой медицины Общества распространения передовой медицины (расположен в городе Кобэ) в глаз 70-летней женщины, страдающей от тяжёлой болезни зрения – дегенерациии (экссудативной) жёлтого пятна – были пересажены ткани пигментного эпителия сетчатки, выращенные с помощью iPS-клеток из кожных клеток самой пациентки.
Исследования возглавил офтальмолог Такахаси Масаё, руководитель проекта Института физико-химических исследований (RIKEN). Основной целью эксперимента была оценка безопасности – учёные намереваются убедиться в приживаемости клеток, а также в наличии либо отсутствии преобразований в раковые клетки более четырёх лет спустя после трансплантации. По прошествии двух лет после операции никаких проблем не возникло. Однако в ходе подготовки к запланированной на 2015 год операции на втором глазу пациентки в ряде iPS-клеток, произведённых из материала пациента, был обнаружен ряд генетических отклонений, в связи с чем от её проведения пришлось отказаться.
В Японии осуществили первую в мире операцию по пересадке клеток сетчатки, выращенных из донорских iPS-клеток
Кобе, 28 марта (Jiji Press) – Группа исследователей, возглавляемая государственным Институтом физико-химических исследований (RIKEN), объявила о том, что провела первую в мире операцию по пересадке клеток сетчатки, созданных из донорских iPS-клеток.
Использование не собственных клеток пациента, а индуцированных плюрипотентных стволовых клеток из банка Университета Киото позволило сократить время и расходы, которые потребовались для операции.
Учёные отметили, что японская регенеративная медицина, использующая стволовые клетки, вышла на новый этап.
Пациент в возрасте более 60 лет из преф. Хёго в Западной Японии страдает экссудативной возрастной макулярной дегенерацией – заболеванием, которое может приводить к слепоте.
В ходе операции, проводившейся 28 марта в Кобе и занявшей около часа, в правый глаз пациента было введено 50 мкл жидкости, содержащей около 250 000 пигментированных эпителиальных клеток сетчатки, выращенных из донорских iPS-клеток.
[Авторское право Jiji Press, Ltd., отредактировано Nippon.com]